
由丙型肝炎病毒 (HCV) 引起的急慢性丙型肝炎已成为全球性严重威胁人类健康的疾病。目前全世界已有超过 1.7 亿人感染了 HCV,仅在中国就有超过 3800 万的感染人群。丙肝的标准治疗方案 (Standard of Care, SOC) 在过去很长一段时间依赖于利巴韦林和干扰素,该治疗方案存在很多的不足:如治疗周期长,毒副作用大,病毒持续响应率低等。随着直接作用于病毒抗 HCV 药物 (Direct Acting Antivirals, DAAs) 的批准上市,丙肝的治疗已然发生了革命性的改善。尤其是在 2013 年底由美国 FDA 批准上市的 Sofosbuvir,其对所有基因型的 HCV 病毒都表现出较强的抑制活性。人们甚至认为 Sofosbuvir 是 HCV 病毒的终结者。显然,这样的观点过于乐观。丙肝的临床治疗还面临很多的挑战:如病毒耐药、基因 3 型患者的治疗、昂贵的治疗费用等。因此,研发新型抗 HCV 药物仍然是药物研究和开发的一个热点。

天然产物向来是药物先导物发现不可或缺的源泉。中国医学科学院北京协和医学院医药生物技术研究所的李卓荣教授课题组发现木豆素(图 1)具有较强的抑制 HCV 病毒复制的活性((EC50=3.17 μM)。然而,从木豆素的化学结构不难看出,其作为药物小分子存在一些缺陷和不足:如分子疏水性很强(AlogP= 5.0),水溶性差,其药代动力学属性很可能较差。因此,李卓荣教授课题组首先完成了木豆素的化学全合成工作 (Acta Pharmaceutica Sinica B, 2011, 1, 93-99),并对木豆素进行了系统的结构优化。随后作者对合成得到的衍生物进行体外抗 HCV 病毒活性的研究,并总结出相应的构效关系。实验结果显示,木豆素结构中的两大疏水基团(苯环 A 和异戊烯基)均不是活性必须基团(图 2),这对进一步的结构优化提供了非常有价值的指导。彭宗根教授对木豆素抗 HCV 的作用机制进行系统的研究。实验结果发现,木豆素对常见的病毒蛋白均无明显抑制作用。基因芯片的结果表明,木豆素能明显降低宿主细胞硫酸软骨素 N - 乙酰氨半乳糖胺基转移酶 1(CSGalNAcT-1)蛋白的水平,有趣的是,木豆素对 CSGalNAcT- 1 基因的表达并没有影响,表明木豆素可能通过加速 CSGalNAcT- 1 蛋白的降解而抑制 HCV 病毒的复制。彭宗根教授随后利用 siRNA 技术降低细胞 CSGalNAcT- 1 蛋白的表达,发现 HCV 病毒的复制受到严重抑制。这些结果证明了 CSGalNAcT- 1 蛋白对 HCV 的复制起到了至关重要的作用。
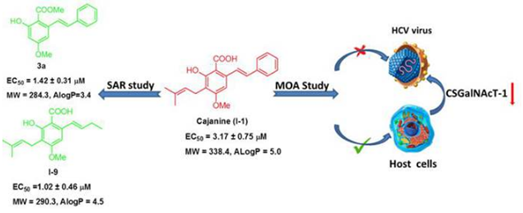
与该抗 HCV 特异作用机制一致的是,木豆素对 DAAs 耐药株均表现出与野生株相当的抗病毒活性,而且其与 DAAs 的联用对 HCV 病毒的复制也呈现出协同抑制作用。综上所述,木豆素作为一类新型抗 HCV 病毒先导物表现出对抗病毒耐药的潜力,具有良好的应用开发前景。目前,李卓荣教授课题组正在进行对木豆素进一步的结构优化以及化学蛋白质组学的研究。
文章的第一作者是医药生物技术研究的季兴跃博士和在读博士生陈金花,通讯作者是李卓荣教授和彭宗根教授。
Design and Synthesis of Cajanine Analogues against Hepatitis C Virus through Down-Regulating Host Chondroitin Sulfate N-Acetylgalactosaminyltransferase 1
Abstract There still remains a need to develop new anti-HCV agents with distinct mechanism of action (MOA) due to the occurrence of resistance to direct-acting antiviral agents (DAAs). Cajanine, a stilbenic component isolated from Cajanus cajan L., was identified as a potent HCV inhibitor by phenotypic screening in this work (EC50 = 3.17 ± 0.75 μM). The intensive structure optimization provided significant insights into the structure–activity relationships. Furthermore, the MOA study revealed that cajanine inhibited HCV replications via down-regulating a cellular protein chondroitin sulfate N-acetylgalactosaminyltransferase 1. In consistency with this host-targeting mechanism, cajanine showed the similar magnitude of inhibitory activity against both drug-resistant and wild-type HCV and synergistically inhibited HCV replication with approved DAAs. Taken together, our study not only presented cajanine derivatives as a novel class of anti-HCV agents but also discovered a promising anti-HCV target to combat drug resistance.
原文链接:http://pubs.acs.org/doi/full/10.1021/acs.jmedchem.6b01301



